Home page > Appunti di Fisica > Es. 52 pag 216 sulle pressioni parziali dei gas

Es. 52 pag 216 sulle pressioni parziali dei gas
sabato 1 febbraio 2014
In allegate alcune pagine con altri esercizi per il ripasso ( a vostro piacimento)
Tenete a mente quanto detto in classe relativamente all’esercizio sulle bombole di gas.
Dunque considerando la legge del gas perfetto:
![]()
Indichiamo con ![]() le moli dell’elio e con
le moli dell’elio e con ![]() quelle del diossido di carbonio, con
quelle del diossido di carbonio, con ![]() quelle degli altri gas
quelle degli altri gas
![]()
si può anche riscrivere come
![]()
dove abbiamo chiamato ![]()
![]() e
e ![]() le pressioni parziali, cioè i contributi dei diversi gas che compongono l’atmosfera di Venere:
le pressioni parziali, cioè i contributi dei diversi gas che compongono l’atmosfera di Venere:
Noi non conosciamo ![]() e
e ![]() , ma conosciamo il loro rapporto:
, ma conosciamo il loro rapporto:
![]()
Poiche ![]() e
e ![]() sono direttamente proporzionali a
sono direttamente proporzionali a ![]() e
e ![]() si ha anche
si ha anche
![]()
da cui
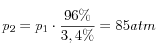
Per la pressione complessiva:
![]()
quindi
![]()
![]()
